


| 黄酮类化合物原花青素C1能够靶向衰老细胞,延长小鼠寿命 |
| 时间:2022-11-11 15:41:14 点击: 次 |
全球顶级学术期刊《Nature》旗下子刊《Nature Metabolism》刊发由我国学者领衔,首次发现从某种特定葡萄籽内提取的天然物质PCC1,可降低有促衰效应的SASP,并高效清除衰老细胞,干预期间延长了自然衰老小鼠中位寿命64.2%[1]。
衰老被认为是多种慢性疾病的最大风险因素之一,极大影响到人类健康与社会发展[2]。
作为衰老的九大标识之一[3],细胞衰老的最初研究可追溯到20世纪60年代,研究人员发现,细胞在衰老过程中,不可避免经历细胞周期停滞、染色质形态改变等事件,促使大量促炎因子分泌【备注:这一特征被称为衰老相关分泌表型(SASP)】,加速机体全面衰老[4]。衰老细胞可作为药物调控靶点,预防或延迟多种衰老并发症(如动脉粥样硬化、骨关节炎等),延长机体健康寿命[5]。
全球顶级学术期刊《Nature》旗下子刊《Nature Metabolism》正式刊发衰老细胞清除物质:PCC1
2015年,全球顶级医疗机构,美国梅奥医学资深教授James L. Kirkland首次提出Senolytics疗法,“seno”意为衰老,而“lytic”则是摧毁,并同时发现了首个可用于清除衰老细胞的药物达沙替尼[6](该药物是一种口服生物可利用的合成小分子SRC家族蛋白酪氨酸激酶抑制剂,原用于治疗慢性粒细胞白血病[5])。自此,此类能通过干扰衰老细胞抗凋亡通路、选择性清除衰老细胞的物质不断涌现[7],目前,包括合成或天然物质在内,主要的Senolytics药物还包括ABT-263、漆黄素、槲皮素等[8]。
但同时,Senolytics药物也并非十全十美,长期使用可能会造成血小板和中性粒细胞减少等不容小觑的副作用[9],若采取间歇性给药的方法,虽能一定程度避免上述副作用,但疗效受限,且无法彻底避免药物脱靶效应[7]。这些因素无疑限制了当下多数Senolytics药物的实际应用。
本次研究由中科院上海营养与健康研究所孙宇研究员主导,汤臣倍健营养健康研究院张旭光教授、衰老细胞研究领域的顶级专家Judith Campisi院士、James L. Kirkland教授均位列作者。

葡萄籽中的PCC1——天然衰老细胞清除剂
本次研究中,当学者对多达46种植物来源的成分库(PDMA库)开展大规模筛选后,一类葡萄的提取物(GSE)被发现。体外试验发现,较低浓度(0.1875μg/ml)GSE可改变衰老细胞的表达谱(2644个基因表达下调,1472个基因表达上调),降低了促进衰老的SASP,并抑制NF-κB促炎信号通路表达,调整了衰老细胞的代谢过程,如信号转导、细胞间通讯、能量调节、细胞代谢和炎症反应。
当研究人员继续增加GSE浓度,发现在体外条件下,当GSE达到较高浓度(0.75μg/ml)后,衰老细胞开始大幅减少。并且,随着浓度增加,GSE的衰老细胞清除能力进一步增强,在3.75μg/ml时效果最好,此时衰老细胞的存活率仅为20%。
格外值得一提的是,即使是15μg/ml的高浓度,正常细胞的增殖也未受影响。
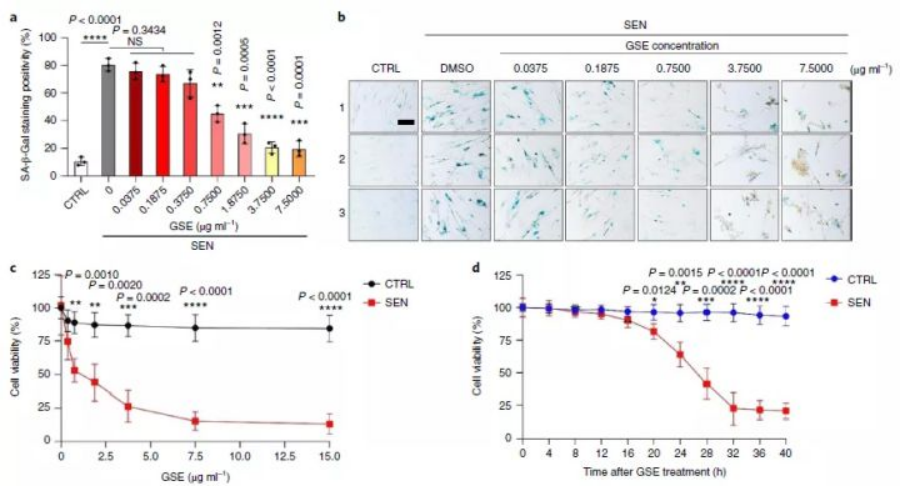
借助液相色谱-联合质谱(简称:LC-MS)技术手段,研究人员开始对GSE的化学成分进行分析。最终,学者将目光聚焦到此次研究中GSE内被大量检出的一种黄酮类物质PCC1(原花青素C1),早前,原花青素就曾被发现具有减少氧化损伤、抑制炎症等多种功能[10-12]。
进一步试验证实,单独使用PCC1处理衰老细胞,当其浓度达到50μM,便对衰老基质细胞具有清除作用,且清除能力与剂量存在关联,在PCC1 200μM时到达巅峰。与先前GSE试验结果相同,PCC1也并未影响非衰老细胞的正常增殖。
此外,后续研究还表明,PCC1清除衰老细胞的能力不受细胞类型影响。
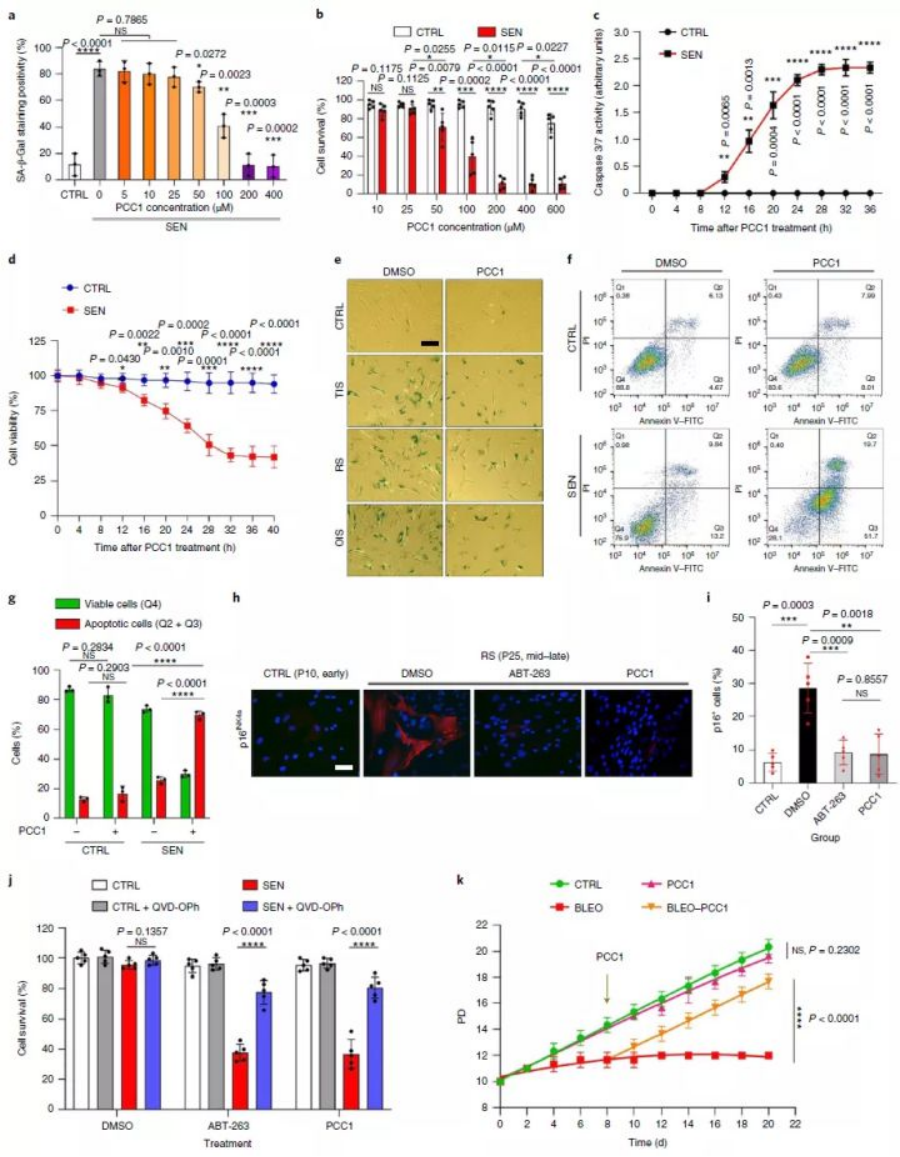
这在于PCC1对BCL-2(B细胞淋巴瘤2)抗凋亡蛋白家族的识别与调控。
作为一种调节蛋白,BCL-2在衰老细胞中过量表达,促使细胞对凋亡刺激产生抗性[13]。而PCC1可通过上调BCL-2家族中NOXA与PUMA两种典型调节蛋白水平[14, 15],并同时调控蛋白酶Caspase3活性[16]与p53信号通路,通过细胞凋亡途径裂解衰老细胞。而试验中检测到线粒体功能障碍(如膜电位升高)与ROS(活性氧自由基)大量生成也证实了该点。
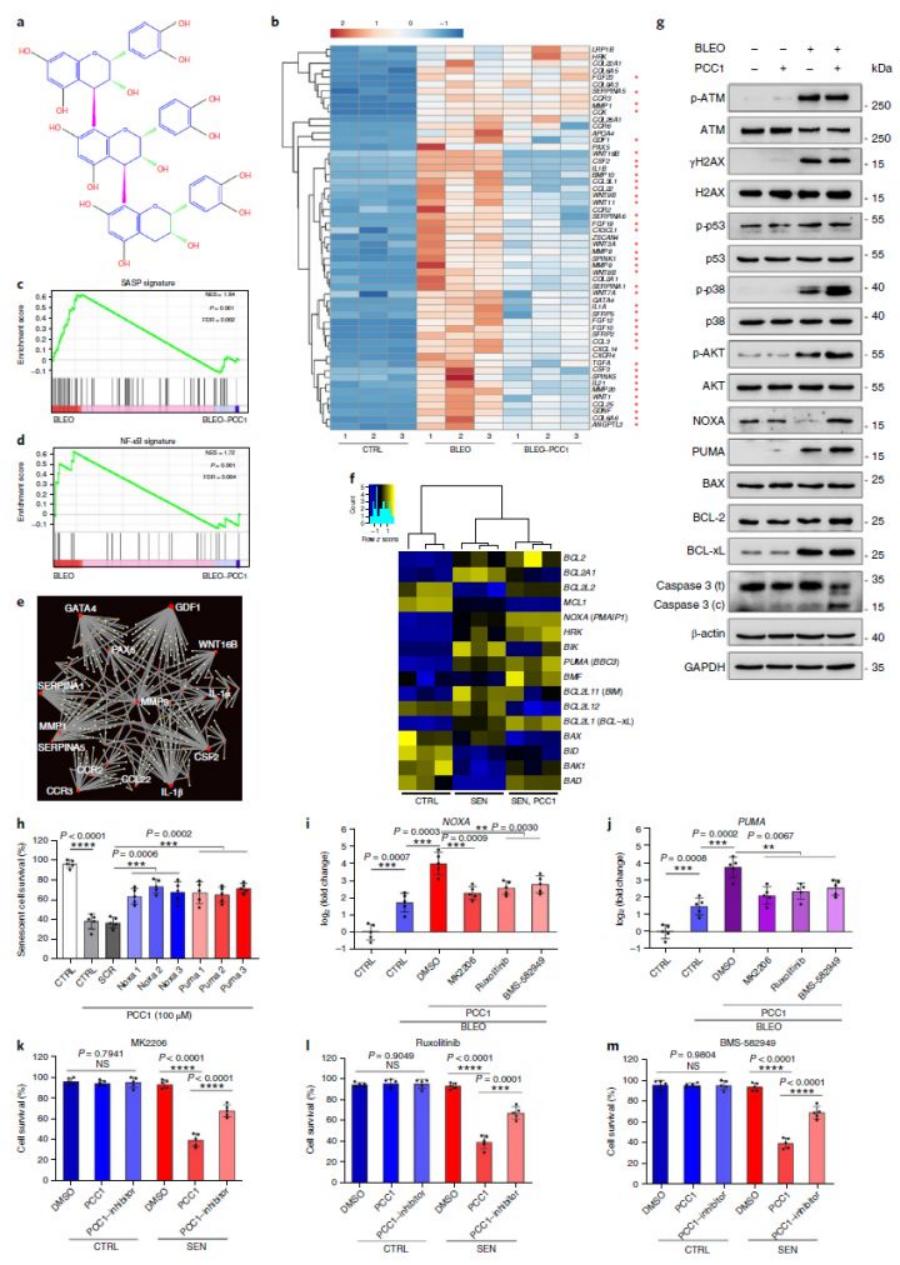
PCC1成了可选择性清除衰老细胞的新一代天然Senolytics物质,同时,对于衰老相关疾病也有一定的辅助作用
PCC1改善衰老小鼠身体机能,干预期延长其中位寿命64.2%
向5个月大的年轻小鼠体内移植衰老细胞后,荧光试验表明,这群还只是个“孩子”的小鼠已被诱导衰老。但当这群“早衰小鼠”被注射PCC1后,其体内衰老细胞被清除,包括最大步速、握力在内,多项衰老相关指标得到改善。并且,PCC1的使用时间较为灵活,其活性足以避免衰老细胞诱导的身体功能障碍。
对于中年小鼠(17个月)而言,衰老细胞的积累(试验中人为植入)显著缩短了小鼠的生存期,而使用PCC1后,可延长小鼠的健康期。
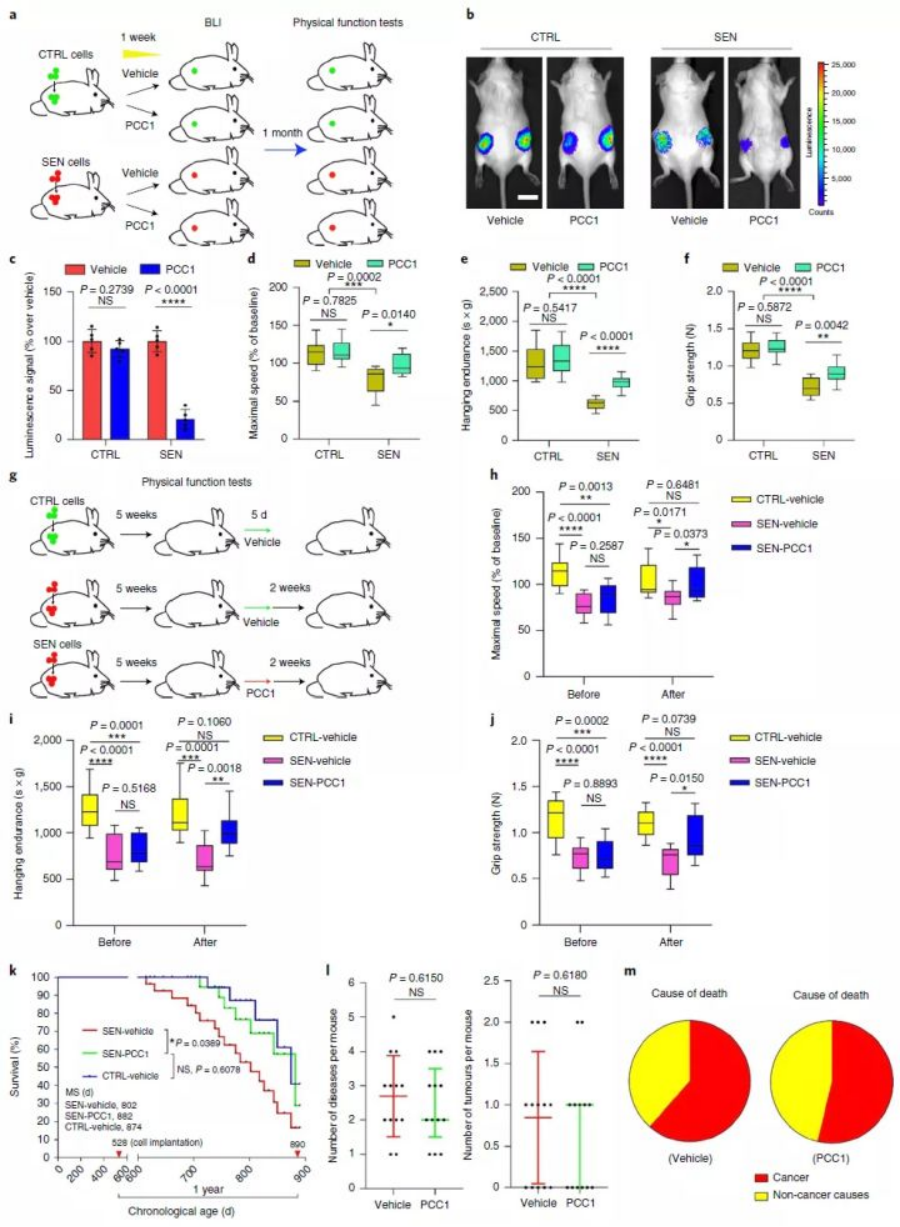
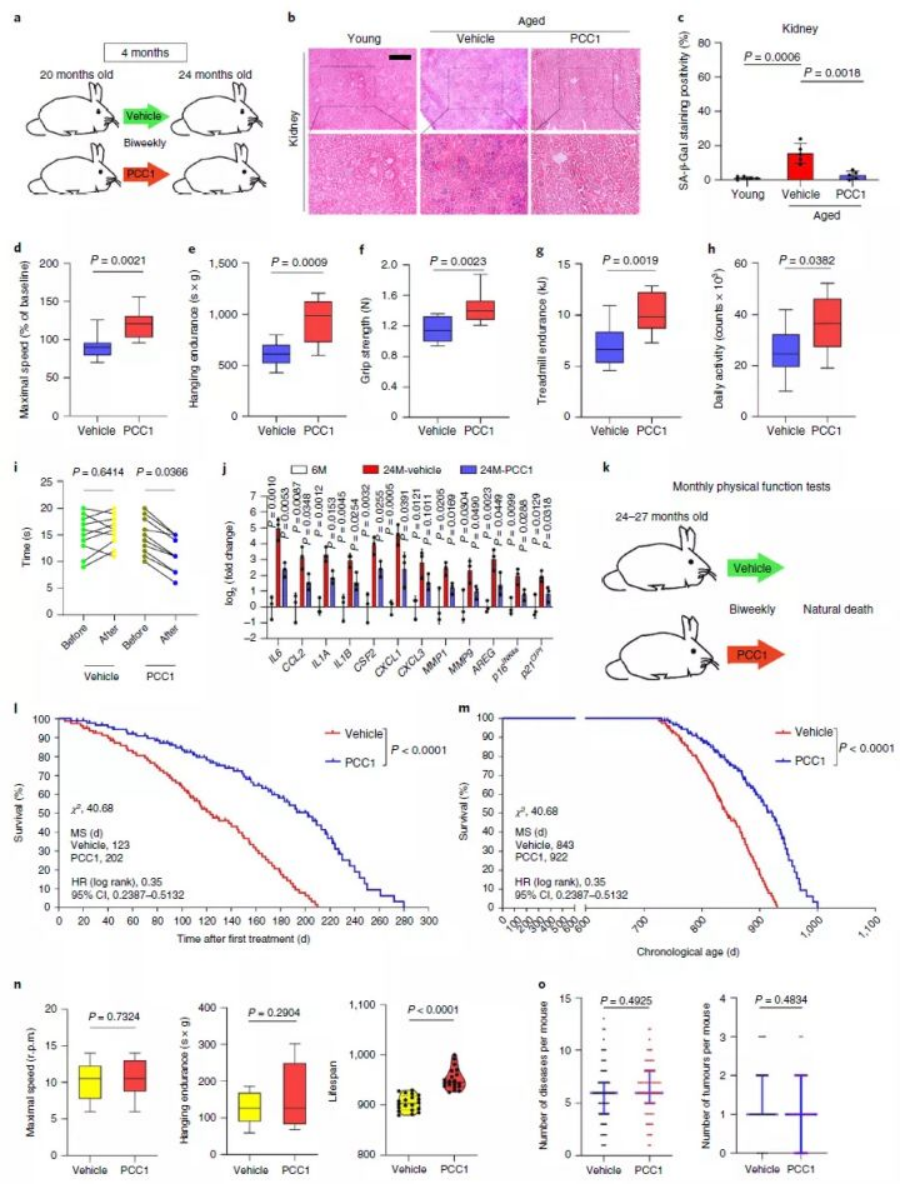
试验再次选择一群已经20个月大的“老鼠”作为研究对象,PCC1不仅改善了其分子层面衰老关联指标(如β-半乳糖苷酶、SASP),也提升了最大步行速度、耐力、握力等外在表现。而24-27个月(大致相当于人类75-90岁)大的“高龄老鼠”使用PCC1后,被发现PCC1令其干预期间中位寿命延长了64.2%(总体中位寿命延长9.4%)。
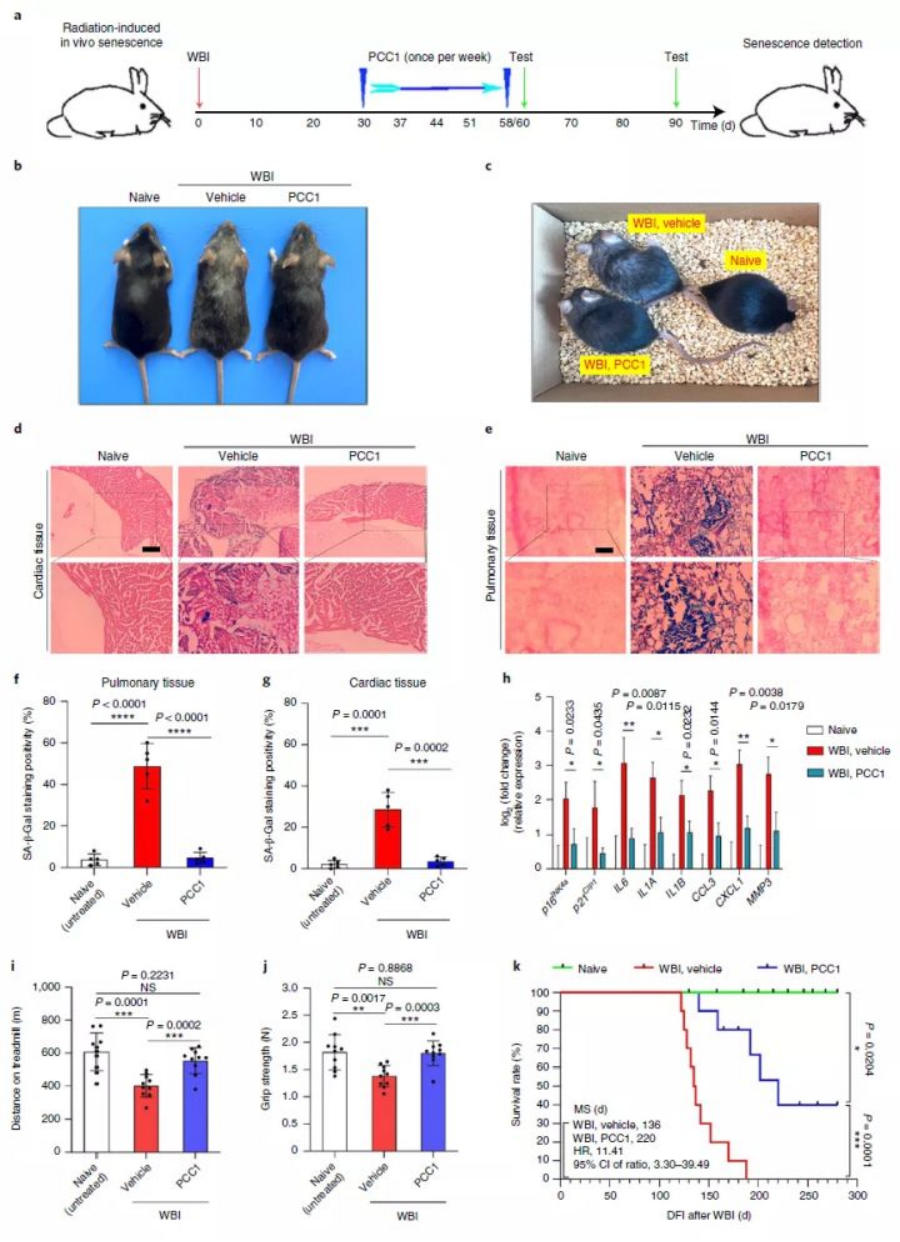
此外,即便小鼠遭受重大外界压力(如强幅射)影响,PCC1也能逆转其机体各项指标恢复年轻态,包括体内衰老标志物β-半乳糖苷酶下降、毛发颜色重返黑亮及运动能力大提升。
综上所述,此次PCC1作为一种全新天然Senolytic物质被发掘,是全球抗衰研究领域中的突破性科研成果。作为衰老细胞清除领域,由我国团队主导、孵化的杰出成果,PCC1必将给予国人更多抗衰信心,让世界听到中国声音!
参考文献
|
| 上一篇:婴幼儿和儿童上呼吸道感染 |

扫一扫关注微信